捷克科学院有机化学与生物化学研究所Vaclav Veverka研究组与美国贝勒医学院H. Courtney Hodges研究组在Science合作发文题为A ubiquitous disordered protein interaction module orchestrates transcription elongation,揭开了转录延伸调控过程中广泛存在的无序序列蛋白质作用网络。

转录延伸过程中,转录伸长因子TFIIS和伸长蛋白elongin通过不同的机制挽救转录中断的聚合酶,从而促进转录中断的恢复【2】。组蛋白伴侣比如FACT、SPT6、LEDGF以及HRP2会通过控制核小体DNA的结构进而协助转录延伸。另外,超级延伸复合体(Super elongation complex)、P-TEFb、PARPs、Mediator以及拓扑异构酶对于有效的转录延伸过程也非常关键。但这些的因子是如何组成一个高效作用的网络景观的还尚未见到全局性的分析。
转录调节因子中存在很多无稳定结构的蛋白序列,一些低复杂性重复序列参与到液-液相分离现象之中,这些较短的线性结构基序通常也会受到翻译后修饰的调控。为了对转录延伸过程因子进行全局性分析,作者们首先对参与到RNAP2转录调控机器的蛋白进行了结构域富集分析,发现在转录起始、转录延伸以及转录终止过程中特异性折叠结构(图1)。在转录延伸过程中广泛存在的折叠结构是TND(TFIIS N-terminal domains),含有TND的蛋白质与基因表达的调控密切相关,而且在转录延伸过程中具有RNAP2而非其他聚合酶特异性。这些结果说明转录延伸调控因子中具有广泛的TND结构域的存在。
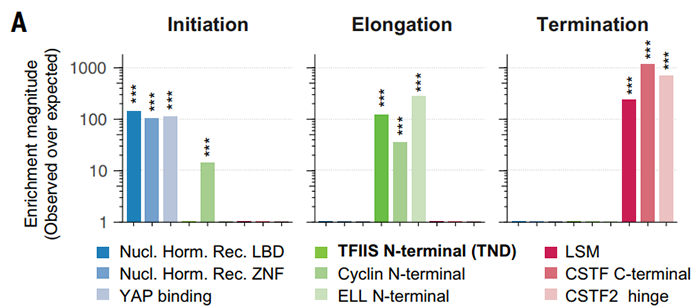
图1 转录起始、转录延伸以及转录终止过程中特异性结构折叠
既然TND是转录延伸因子中广泛存在的结构域,想要形成转录延伸调控网络,这些因子中还会包括TND结合基序,作者们将这一基序称为TIM(TND-interacting motifs)。通过蛋白质组学研究,作者们发现转录延伸调节因子中广泛存在推定的TIM序列(图2)。进一步地通过核磁共振实验,作者们得到了转录延伸调节因子之间依赖于TND:TIM的相互作用网络(图2)。另外,作者们通过化学位移扰动、解离常数测量等方式对TND:TIM相互作用网络中的因子作用模式进行了定量的刻画。
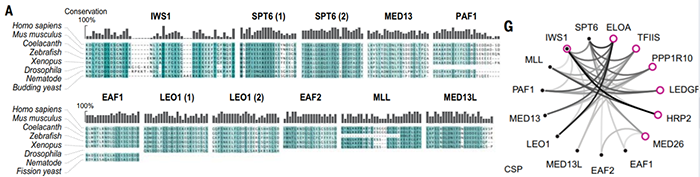
图2 转录延伸调节因子中存在TIM序列以及根据TND:TIM序列形成的相互作用网络
在该网络中IWS1因子由于既包含TND结构域又包含TIM基序(图2),所以可能在转录延伸过程同时结合多个因子,因此作者们后续的一些对于TND:TIM相互作用界面依赖的必要性以及充分性的验证实验集中于IWS1因子上。为此,作者们引入了LacI-LacO的工作系统,发现IWS1-TIM本身可以形成点状信号,该点状信号可以特异性招募多个转录延伸因子。该结果说明TIMs足以在活体细胞中招募TNDs。通过荧光漂白恢复实验作者们发现二元TND-TIM结合点状信号荧光活性很短暂,说明该结合半衰期很短且是高度动态变化的过程。进一步地,通过在TIM结构域引入突变会使得TND的结合被废除这一现象,说明TND-TIM的二元相互作用依赖于TIM的序列特征。
随后,作者们对IWS1的相互作用进行评估,进行了FLAG-IWS1的质谱实验,从而建立起IWS1的相互作用组图谱。进一步地,作者们在IWS1的TIM区域引入突变,发现该突变会导致选择性地失去TND结构域包含蛋白的相互作用,从而影响RNAP2在转录延伸过程中的相互作用网络。另外,作者们通过对IWS1 TIMs以及与TFIIS、PPP1R10 TNDs蛋白的结构解析,作者们证明了该结合作用界面的保守性,同时也证明了IWS1是通过TND-TIM界面维持多种因子相互作用的一个中心节点。
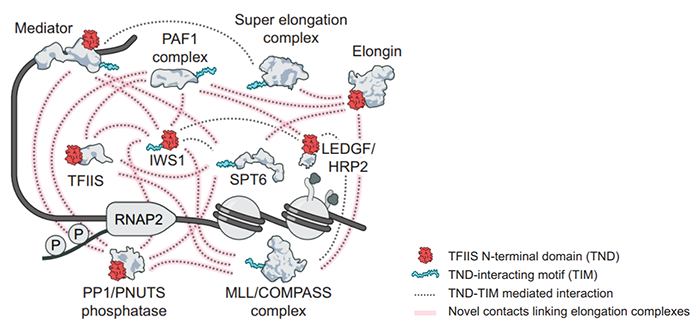
图3 工作模型
总的来说,该工作建立了转录延伸过程中多种调控因子调节其相互作用网络的具体机制,发现了TND结构域通过调节与内在无序序列也就是文中定义的TIM基序之间的相互作用建立起的TND:TIM作用界面,像是分子胶水维持和协调转录延伸调节因在拥挤的细胞核环境中的稳定存在和精确调控,同时也发现IWS1会作为一个TIM平台,协助其他因子的相互作用确保转录延伸的有效进行(图3)。













